Sel punca (stem cell)
merupakan sel yang relative belum terspesialisasi dan dapat mereproduksi diri sendiri
secara tak terbatas dan apabila terdapat pada kondisi yang sesuai maka sel-sel
tersebut dapat berdeferensiasi menjadi sel-sel terspesialisasi dari satu tipe
sel atau lebih (Cambell N. A. et al. 2008).
Selain itu juga, dibanyak jaringan mereka bertindak layaknya system perbaikan
internal (Internal Repair System), ketika Stem cell membelah,
masing-masing sel baru memiliki potensi tetap sebagai Stem cell atau menjadi
sel jenis lain dengan fungsi yang spesifik, seperti sel otot, sel darah merah,
atau sel otak (Saputra V. 2006).
1.
Dogma
Lama yang Terbantahkan
Stem cell atau dalam bahasan
Indonesia lebih dikenal dengan istilah sel punca merupakan sel, atau jaringan
yang tidak/belum terspesialisasi dan
mempunyai 2 sifat (Saputra V. 2006):
1. Kemampuan untuk berdiferensiasi menjadi sel lain
(differentiate). Dalam hal ini stem
cell mampu berkembang menjadi berbagai jenis sel matang, misalnya sel saraf,
sel otot jantung, sel otot rangka, sel pankreas, dan lain-lain.
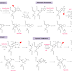
Gambar 1. Perkembangan sel embrio dan sifatnya (Yu Junying dan Thomson J.
A. 2006).
|
2. Kemampuan untuk memperbaharui
atau meregenerasi dirinya sendiri (self-regenerate/self-renew).
Dalam hal ini stem cell dapat membuat salinan sel yang persis sama dengan
dirinya melalui pembelahan sel.
Berdasarkan kemampuan
berdiferensiasi, stem cell dibagi menjadi beberapa sifat, yaitu:
Totipotent. Masing-masing sel dapat berkembang menjadi individu baru.
Yang termasuk dalam stem cell totipotent adalah zigot (telur yang telah dibuahi
yang baru berumur 1-3 hari) (Saputra V. 2006,
Yu Junying dan Thomson J. A 2006, Pratiwi
R. 2012). Pluripotent. Dapat berdiferensiasi menjadi 3 lapisan germinal:
ektoderm, mesoderm, dan endoderm, tapi tidak dapat menjadi jaringan ekstrem
bryonik, selain itu Sel dapat membentuk lebih dari 200 tipe sel (Saputra V. 2006, Yu Junying
and Thomson J. A 2006, Pratiwi R. 2012). Teori lama menyebutkan
sel seperti ini hanya dapat ditemukan pafda embrio yang berumur 5-14 hari, akan
tetapi dalam makalah ini disebutkan sifat ini dapat terjadi pada sel dewasa. Multipotent. Dapat berdiferensiasi
menjadi banyak jenis sel. Misalnya: hematopoietic stem cells, Jaringan janin, tali pusat, darah, dan stem
cells dewasa (Saputra V. 2006). Unipotent, hanya dapat menghasilkan 1 jenis sel (Pratiwi
R. 2012). Tapi berbeda dengan non-stem cell, stem cell unipoten mempunyai sifat
dapat memperbaharui atau meregenerasi diri (self-regenerate/self-renew) (Gambar
1) (Pratiwi R. 2012).
Dogma biologi yang
selama ini di pegang bahwa sel dewasa pada hewan tidak akan terprogram untuk
berdeferensiasi kini goyah. Dr. John B.
Gurdon dan Dr. Shinya Yamanaka merupakan orang yang paling berjasa yang
mengubah persepsi tersebut (Nobel prize committee, 2012). Dr. John Bertrand Gurdon
adalah seorang ahli biologi berkebangsaan
Inggris, University of
Cambridge. Beliau dikenal untuk penelitian dalam kloning dan transplantasi nuklir, Dr Gurdon menerima
Penghargaan Lasker pada tahun 2009 dan sekarang Hadiah Nobel untuk Fisiologi atau Kedokteran 2012. Gurdon
lebih popular padan masanya yaitu
sekitar tahun
1995, penghargaan nobel diberikan
berkat jasanya untuk pertama kalinya mengklon telur berudu (Nobel
Prize Committee, 2012).
Gambar 3.
Percobaan Dr. John B. Gurdon (Nobel prize committee, 2012).
1.
Penghilangan
inti sel dengan menggunakan UV.
2.
Penggantian
inti sel dengan inti sel dari sel epitel usus kodok
3.
Beberapa
berkembang dan beberapa tidak berkembang
4. Uji coba pada hewan hewan mamalia
|
Cara yang sama sebenarnya pernah dilakukan oleh Robert
Bringgs dan Thomas King pada tahun 1952, percobaan tersebut menggunakan Rana pipiens, Penggantian inti sesama
embrionik dapat tumbuh sampai berudu, akan tetapi apabila diganti dengan inti
dari sel somatik maka tidak akan dapat tumbuh, mereke berkesimpulan faktor tumbuh tersebut telah hilang sehingga tidak dapat
berkembang menjadi individu baru. Percobaan serupa dilakukan oleh John B.
Gurdon, dengan menggunakan Xenopus laevis
dengan meneruskan penelusuran gurunya Fichberg dan Colleagues (Nobel prize committee, 2012).
John B. Gurdon menggunakan UV untuk
menghilangkan inti sel telur kodok, kemudian diganti dengan inti sel epitel
usus, beberapa sel yang hasilkan tidak tumbuh, akan tetapi beberapa sel yang
lain dapat tumbuh menjadi berudu (Nobel prize committee, 2012). Pada percobaan-percobaan berikutnya di uji cobakan ke
hewan-hewan mamalia, sehingga percobaan inilah yang menjadi dasar Klonning
(Gambar 3).
Gambar
4. Tingkat Penerimaan Clonning berdasarkan moral menurut agama Islam
(Pratiwi R.
2012).
|
Dr.
Shinya Yamanaka yang berasal
dari Kyoto university merupakan director
Center for iPS Cell Research and Application dan seorang profesor di the Institute for Frontier Medical Sciences di Universitas Kyoto (Takahashi K., dan Yamanaka, S. 2006). Hasil
penelitiannya telah membongkar paradigma lama yang berpendapat bahwa sel hewan
akan kehilangan sifat pluripotentsinya apabila sel tersebut telah dewasa.
Pengujian dilakukan dengan mencoba mengaktifkan reprogramming sel dengan
memasukkan gen tertentu melalui perantara virus. Penemuannya merupakan langkah
besar mengingat masih berkecimuknya penggunaan Embrionic stem cell pada
beberapa Negara (Saputra V. 2006) (Gambar 4).
A.
2. Metode iPS (induced Pluripotent
Cell) dan Penelitian Terkait
Gambar
5. Pengujian iPS (induced
Pluripotent Cell) (Rodolfa T. K. dan Eggan K. 2006)
A.
Transformasi cDNA dan G418 selection.
B.
Seleksi gene, sel positif menghasilkan β-galaktosidase dan menjadi resisten terhadap konsentrasi
tinggi neomisin.
C.
ES (embryonic stem cell), iPS-MEF(mouse embryonic fibroblasts)
|
Pengembangan Induced pluripotent
cell atau disingkat “iPS” sebenarnya
merupakan arah pemikiran logis dari penelitian yang pernah ada, peristiwa
pembuatan hewan cloning pada hewan, secara tidak langsung membuat pemikiran
bahwa meskipun yang di transfer adalah inti dari sel dewasa, akan tetapi dalam
perkembangannya, inti sel yang bisa dikatakan dewasa tadi, tetaplah
mengkoordinir atau memicu perkembangan pembelahan deferensiasi, dasar lainnya
ditemukannya factor transkripsi dan adanya ESC pada tikus (Yamanaka S. 2012a). Namun selama ini pemahaman sifat ini sulit untuk dipahami, sampai
akhirnya Dr. Shinya Yamanaka mencoba untuk menerjemahkannya. Induksi iPS
dilakukan dengan cara menginfeksikan virus yang membawa gen β-galaktosidase
yang resisten terhadap neomisin untuk seleksi. Retrovirus membawa cDNA yang
khusus yang merupakan molekul calon pemrograman ulang, sehingga sel-sel yang di
hasilkan merupakan sel yang berhasil di rubah menjadi pluripotent. Meskipun
jumlah sel pluripotent yang dihasilkan sedikit, hasil penyeleksian dipermudah
dengan antibiotic tadi (Rodolfa T. K. dan Eggan K. 2006, Takahashi K., dan
Yamanaka, S. 2006, Nobel prize committee, 2012)
(Gambar 5).
Gambar 6.
Pengujian koloni G418 dengan kombinasi gen factor (Rodolfa T. K. dan Eggan
K. 2006).
|
Embryonic
fibroblast dan fibroblast di ambil dari ujung ekor (untuk pengujian) tikus
dewasa, Pada awalnya Dr. Yamanaka, menduga 24 kandidat gen yang dapat
mengaktifkan keadaan sel, sebelumnya senyawa-senyawa ini telah diujikan
terlebih dahulu ke sel embryonic fibroblast (Rodolfa T. K. dan Eggan K. 2006, Takahashi
K., dan Yamanaka, S. 2006, Nobel prize committee, 2012). Kandidat gen-gen
tersebut adalah Ecat1, Dppa5 (Esg1), Fbxo15, Nanog, ERas, Dnmt3l, Ecat8, Gdf3,
Sox1, Dppa4, Dppa, Fthl17, Sall4, Oct3/4, Sox2, Rex1 (Zfp42), Utf1, Tcl1, Dppa3
(Stella), Klf4, β-catenin, c-Myc, Stat3, Grb2, Ips (Rodolfa T. K. dan Eggan K.
2006). Cara penyeleksian menggunakan gen marker dengan
asumsi apabila β- galaktosidase maka sifat pluripotent dapat dipastkan ada.
setelah di analisis lebih lanjut, tersisa sepuluh kandidat senyawa, dan
akhirnya ada 4 senyawa aktif (Rodolfa
T. K. dan Eggan K. 2006, Takahashi K., dan Yamanaka, S. 2006).
Pada
percobaan selanjutnya, koloni tidak terbentuk apabila factor gen Oct3 / 4
atau Klf4 di hilangkan. Penghapusan Sox2 mengakibatkan hanya beberapa
G418-tahan koloni. Ketika c-Myc dihilangkan, G418-tahan juga tidak ada
tanda-tanda pluripotent (Rodolfa T.
K. dan Eggan K. 2006, Takahashi K., dan Yamanaka, S. 2006). Pemindahan satu
factor tidak menunjukkan adanya tanda-tanda pluripotent sehingga disimpulkan
bahwa Oct3 / 4, Klf4, Sox2 , dan c-Myc memainkan peran penting dalam generasi
sel iPS dari MEFs (Yamanaka, S. 2012a). Kombinasi dua factor dari 4 kandidat
tadi juga tidak menghasilkan hasil maksimal, sedangkan pemberian 3 faktor
Oct3/4, Sox2 dan klf4 menghasilkan koloni, tapi penampakannya berbeda dari 4
faktor, hal serupa juga terjadi pada kobinasi Oct3/4, Sox2 dan C-Myc (Gambar 6) (Rodolfa T. K. dan Eggan K. 2006, Takahashi K., dan Yamanaka, S.
2006a).
Sejak
tahun 2006, setelah pertama kalinya stem cell dilakukan pada sel dewasa, banyak
penelitian yang dilakukan, selain karena semakin longgarnya peraturan yang
berkaitan dari segi pemerintah, social, budaya dan agama. Setidaknya ada 100 laporan yang membahas
penelitian ini (Rodolfa T. K. dan Eggan K. 2006). Kekhawatiran menggunakan
virus dalam aplikasi pengobatan membuat para ilmuan dalam beberapa tahun
terakhir memikirkan metode-metode lain. Metode ini meliputi yang dilaporkan
beberapa ilmuan; plasmid, Sendai virus, adenovirus, sintesis RNA, dan protein (Rodolfa
T. K. dan Eggan K. 2006, Nobel prize committee, 2012). Selain itu, upaya telah
dilakukan untuk menginduksi pemprograman ulang oleh molekul kecil. Di
antaranya, plasmid dan Sendai virus sekarang secara rutin digunakan di banyak
laboratorium (Rodolfa T. K. dan Eggan K. 2006, Nobel prize committee, 2012). Di Pusat Penelitian your iPS dan Aplikasi,
Kyoto University, metode favorit yang digunakan adalah menggunakan plasmid
episomal baik retrovirus atau plasmid episomal untuk penelitian in vitro.
Mereka lebih memilih metode ini karena lebih sederhana dan reproduktif (Rodolfa
T. K. dan Eggan K. 2006).
Pada aplikasi medis, dalam waktu yang begitu
singkat setelah ditemukan, banyak penyakit yang dapat disembuhkah antara lain
Amyotrophic lateral sclerosis (ALS), Rett syndrome, spinal muscular atrophy
(SMA), α1-antitrypsin deficiency, familial hypercholesterolemia dan glycogen
storage disease type 1A, dan sebagainya termasuk beberapa syndrome seperti Leopard
syndrome (Nobel prize committee, 2012) dan penyakit Alzeimer yang penelitiannya
sekarang masih berjalan (Israel et al. 2012). iPSCs dapat digunakan dalam
bioteknologi hewan dan rekayasa genetika. Monyet, babi, dan anjing. Di masa
depan, mungkin dapat digunakan untuk transplantasi organ manusia (Yamanaka S.
2012a). strategi yang sama. Sejauh ini para ilmuan masih berusaha mencari
faktor tunggal untuk dijadikan kombinasi.
A. 2.
Tantangan Penelitian
Sampai
saat ini, bersumber dari kesuksesan pemprograman sel dewasa menjadi
pluripotenet, banyak penelitian untuk memastikan kegunaan serta potensinya
untuk di terapkan di dunia kesehatan. Salah satu pertanyaan yang paling
penting tentang iPSCs adalah apakah
mereka berbeda dari ESCs? (Yamanaka S. 2012ab) sampai saat makalah ini
di tulis belum ada yang dapat memastikan mengenari perbedaan antara Embrionik
stem cell degan iPSCs. pertanyaan kedua, apakah kemampuan sel iPSCs secara fungsional berbeda dari ESCs? (Yamanaka S. 2012ab) Perbedaan ini diteliti
melalui penkulturan secara invitro.
Mereka menunjukkan bahwa semua klon ESC dibedakan menjadi PAX6 sel positif,
dengan keberhasilan lebih dari 90%, tetapi klon iPSC menunjukkan diferensiasi yang
lebih sedikit,
berkisar
10% sampai 50% saja (Nobel prize committee,
2012). Namun, Boulting et al., 2011
memeriksa kemampuan 16 klon iPSC manusia berdiferensiasi
menjadi neuron motor dan menemukan bahwa 13 klon sebanding dengan ESCs. Sehingga dapat
disimpulkan yang ada
kesamaan antara iPSCs dan ESCs
(Yamanaka S. 2012b)
.
Gambar 7. Sifat overlapping antara ESC dan iPSC
(Yamanaka, S. 2006a, Yamanaka, S. 2012b)
|
Secara keseluruhan, studi ini
menunjukkan bahwa iPSC klon dan klon ESC telah tumpang tindih dalam
hal sifat (Gambar 7). Data-data yang ada menunjukkan bahwa pemrograman ulang tidak lengkap atau
tidak sempurna bukan masalah mendasar terkait dengan iPSCs
(Yamanaka S., 2012a). Sebaliknya,
perbedaan dalam kualitas klon iPSC tampaknya sebagian besar disebabkan oleh
variabel teknis, seperti kombinasi faktor, metode pengiriman gen, dan kondisi kultur
yang digunakan. Selain itu,
beberapa variasi antara klon iPSC dapat dikaitkan dengan peristiwa stokastik
selama pemrograman ulang, yang tidak dapat dikendalikan. Dengan demikian,
evaluasi dan seleksi akan menjadi penting untuk mengidentifikasi klon iPSC yang
cocok untuk aplikasi medis (Yamanaka
S., 2012a).
KAJIAN PUSTAKA
Cambell N.
A., Reece J. B., Urry L. A., Cain M. L., Wasserman S. A., Minorsky P. V., &
Jackson R. B. 2008. Biologi, edisi 8,
jilid 1. Jakarta= Erlangga.
Cambell N.
A., Reece J. B., Urry L. A., Cain M. L., Wasserman S. A., Minorsky P. V., &
Jackson R. B. 2009. Biology 9th
edition. E-book
Dallman.
2009 video. Youtube. Essential Cell biology, 3 rd Edition by Albert, Bray,
Hopkin, Johnson, Lewis, Raff, Robert, dan Walter. By Gorland Science
Fernholm A.
2012. Cell and sensibility. The royal swedish academy of sciences http://kva.se
Israel et
al. 2012. Probing sporadic and familial Alzheimer’s disease using induced
pluripotent stem cells. doi:10.1038/nature10821
Lefkowitz R.
J., 2004. Historical review: A brief history and personal retrospective of
seven-transmembrane receptors. TRENDS in Pharmacological Sciences Vol.25 No.8
Linse S. S.
2012. Studies of g-protein–coupled
receptors. The nobel committee for chemistry. Box 50005 (lilla frescativägen 4
a), se-104 05 stockholm, sweden
Nobel prize
committee, 2012. Mature cell can be reprogrammed to become pluripotent.
Pratiwi R. 2012.
Aplikasi Dan Rekayasa Materi Genetik Pada Hewan Dan Manusia. PPT matakuliah
rekayasa genetika 2012.
Pressmeddelande, 2012. The Nobel
Prize in Chemistry 2012. BOX 50005, SE-104 05 Stockholm, Sweden.
Rodolfa T.
K. dan Eggan K. 2006. A Transcriptional Logic for Nuclear Reprogramming. Cell
126, August 25, 2006 ©2006 Elsevier Inc : 652-656.
Saputra V.
2006. Dasar-dasar Stem Cell dan Potensi Aplikasinya dalam Ilmu Kedokteran. Business Development
Corporate Department, PT Kalbe Farma Tbk. Jakarta, Indonesia. Cermin Dunia
Kedokteran No. 153.
Steward K.
B. 2007. The Human Genetic Code- The
Human Genome Project and Beyont. (www. Genetic. Edu. Au).
Takahashi,
K., dan Yamanaka, S. (2006). Induction of Pluripotent Stem Cells from Mouse
Embryonic and Adult Fibroblast Cultures by Defined Factors. J. Cell. 126.
Yamanaka S.
2012a. Induced Pluripotent Stem Cells: Past, Present, dan Future Shinya. Cel
press DOI 10.1016/j.stem.2012.05.005.
Yu Junying dan Thomson J. A 2006. Embryonic
Stem Cells. Science 20 Jan 2006; Vol. 311. No. 5759, p. 335
http://chile.usembassy.gov